Обзор лекарственных препаратов
Осторожно: лекарства!
Ганджен Синха
Продвижение на рынок новых лекарств превратилось в спорт - так считает Питер Лурье (Peter Lurie), член вашингтонской общественной группы Public Citizen. В последнее время настороженность подобных организаций весьма обоснована. По словам Лурье, сегодня фармацевтические компании полностью контролируют свои исследования и зачастую манипулируют данными или утаивают невыгодные для них результаты.
Два года назад Управление по контролю за продуктами и лекарствами (FDA) одобрило производство лотронекса (гидрохлорида алосетрона) - препарата, предназначенного для лечения слизистого колита. По данным клинических испытаний, опубликованным в журнале Lancet, у 41% женщин, принимавших новое средство, отмечалось некоторое улучшение,как, впрочем, и у 29% пациенток, получавших плацебо.
По мнению Лурье, эти выводы крайне обманчивы. Во-первых, на приведенном графике указаны не абсолютные значения измеряемых величин, а относительные. Создается иллюзия, что препарат весьма эффективен. Лурье привел удачную аналогию: «Иисуса предали 8% апостолов, а именно лишь один из 12». Во-вторых, не были представлены данные о первом месяце наблюдений, когда препарат и плацебо действовали одинаково. Группа Public Citizen направила в Lancet новый график, построенный с использованием абсолютных значений величин и свидетельствующий о сомнительной эффективности лекарства.
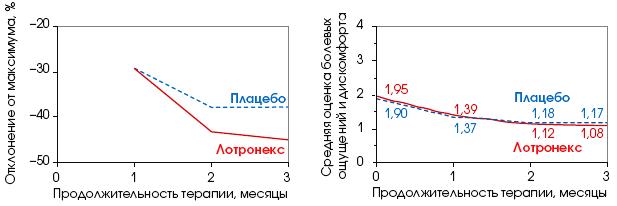
Кривые графики
Лотронекс (алосетрон) выглядит гораздо эффективнее плацебо, если на графике отмечать относительное отклонение измеряемой величины от максимума (слева). Но стоит только перестроить кривые с использованием абсолютных значений, и эффективность лекарства сразу становится весьма сомнительной - никакой разницы между действием нового препарата и плацебо не наблюдается (справа). Оба графика опубликованы в журнале Lancet.
Майкл Кэмиллери (Michael Camilleri), руководивший исследованиями в Рочестерской клинике «Майо» (штат Миннесота), отверг все обвинения, заявив: «Подобное представление результатов - общепринятая практика для серьезных научных журналов. Данные четко указывают на высокую эффективность препарата после приема в течение двух-трех месяцев».
Есть и другая общепринятая практика - замалчивание нежелательных результатов. «Это недопустимо для научных публикаций, - заявляет Боб Гудман (Bob Goodman), основатель нью-йоркского издания No Free Lunch, занимающегося разоблачением маркетинговых уловок фармацевтических компаний. - Как врач может назначать то или иное лекарство, если его производитель утаивает важнейшую информацию?»
Показательный пример - скандал вокруг ингибиторов Cox-2, разрекламированных в качестве безопасной альтернативы нестероидным противовоспалительным средствам, таким как ибупрофен. В 2001 г. объем продаж одного из таких ингибиторов, целебрекса, достиг колоссальных размеров - $3 млрд. А в прошлом году в The Washington Post появилась статья о том, что компания Pharmacia, производящая препарат, обнародовала результаты только первых шести месяцев испытаний. И неспроста: данные за следующие полгода показали, что у пациентов, принимавших целебрекс, язва желудка возникала не реже, чем у тех, кто принимал ранее выпускавшиеся лекарства. В свое оправдание представители Pharmacia заявили, что результаты, полученные за последние шесть месяцев, слишком противоречивы, чтобы их опубликовать.
Ходят слухи, что FDA, как ни странно, проявляет все большую благосклонность к фармацевтическим компаниям. История с лотронексом подлила масла в огонь. Препарат поступил на рынок в феврале 2000 г., и вскоре Полу Столли (Paul D. Stolley) из Мэрилендского университета было поручено проанализировать его побочное действие. Тогда-то и начала вырисовываться удручающая картина: каждый день в больницах оказывались все новые пациенты, принимавшие лотронекс, при том, что их недуг никогда не приводил к госпитализации, не сопровождался прободением толстой кишки и не был смертельно опасен.
В ноябре 2000 г. в печати появилось сообщение о 49 случаях ишемических колитов и трех летальных исходах в результате приема лотронекса, и его производитель GlaxoSmithKline отозвал препарат из аптек. Однако спустя несколько месяцев компания обратилась в FDA с просьбой разрешить ей вернуть препарат в торговую сеть, ссылаясь на многочисленные обращения больных слизистым колитом. Понимая, что отрицательные последствия применения лотронекса с лихвой перекрывают его сомнительные преимущества, Столли сильно встревожился, однако сотрудникам управления запретили обсуждать с ним этот вопрос,несмотря на то, что в течение последних 30 лет он был консультантом FDA. «Не я один выступал против лотронекса, но всех остальных попросту запугали», - пояснил Столли.
Бытует мнение, что FDA стало снисходительно относиться к фармацевтическим фирмам после того, как в 1992 г. был принят закон, согласно которому компании должны выплачивать управлению по $500 тыс. за каждый одобренный препарат. Подобные взносы покрывают почти половину затрат FDA на испытание новых лекарств.
«Я потрясен: наше руководство не дрогнуло даже после того, как стали известны случаи подтасовки данных и замалчивания негативных результатов. Похоже, управлению удобнее сотрудничать с компаниями, чем с собственным персоналом», - с горечью замечает Столли. Сейчас лотронекс продают только по рецепту врача, а пациент обязан письменно подтвердить, что он осведомлен о возможных негативных последствиях применения препарата. Что ж, по крайней мере, теперь больные идут на риск сознательно.
По материалам журнала «В мире науки» №6 за 2003 год
Закладки по теме: лотронекс, алосетрон
Комментариев: 0










 Чтобы сообщить нам о грамматической ошибке на сайте
выделите её и нажмите Ctrl+Enter
Чтобы сообщить нам о грамматической ошибке на сайте
выделите её и нажмите Ctrl+Enter