Тематические статьи

Атеросклероз: артиллерия бьет по своим
Артиллерия бьет по своим.
Это наша разведка, наверно,
Ориентир указала неверно.
Недолет. Перелет. Недолет.
По своим артиллерия бьет.
Александр Межиров
О нем плохо говорят и еще хуже пишут. О нем шепчутся на поминках. На борьбу с ним тратятся миллиарды. Чтобы его понять, защищают тысячи диссертаций и пишут тысячи научных статей. А он присутствует в каждой нашей клетке, и без него — никак.
Говоря точнее, он содержится в организмах всех животных, но отсутствует в растениях. Он необходим для образования и восстановления клеточных мембран, для формирования связей между клетками мозга, для обучения и памяти, для синтеза гормонов (в частности, половых — эстрогена и тестостерона), а также для образования витамина D на поверхности кожи под действием ультрафиолета. Он — это холестерин.
Треть его мы получаем с едой, две трети синтезирует печень, причем синтез стимулируют насыщенные жиры, которые содержатся в животной и молочной пище. Холестерин не растворим в воде, поэтому в крови он всегда упакован в липопротеины — округлые частицы, которые переносят по кровотоку липидные молекулы. Именно таким способом холестерин путешествует из печени в ткани. А если он в избытке — из тканей обратно в печень, где излишний холестерин утилизируется (или реутилизируется).
Традиционно считается, что причина атеросклероза, а также большинства сердечно-сосудистых заболеваний — повышение уровня холестерина в плазме крови. Но в последнее время много говорят о «хорошем» и «плохом» холестерине. В чем разница между ними?
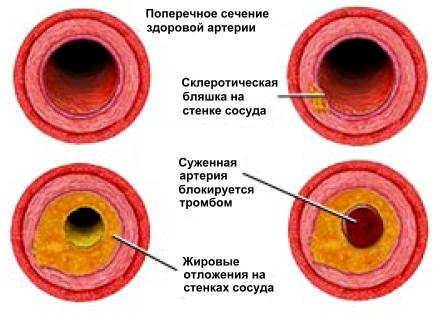
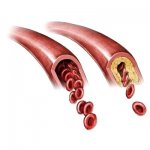
Рис. 1. Возникновение и развитие атеросклероза
Основной виновник атеросклероза — так называемый «плохой» холестерин, тот, который идет из печени в ткани и органы. Но «плохим» он становится только при плохом раскладе, когда начинает образовывать на внутренних стенках артерий жировые образования — бляшки. Маленькие бляшки остаются мягкими, но более старые, большие бляшки могут образовывать фиброзные шляпки, в которых откладывается кальций, — происходит кальцификация артерий. Это приводит к атеросклерозу: к сужению артерий и их затвердеванию. А это, в свою очередь, может вести к двум последствиям: кальцинированные и неэластичные артерии становятся узкими (именно это называют стенозом), скорость кровотока в них замедляется, так что кровь, обогащенная кислородом, не поступает в сердце (рис. 1). Возникает кислородная недостаточность — ишемия. За ней — ишемическая болезнь сердца, боль - стенокардия, а иногда сердечный приступ.
Второй вариант развития событий еще хуже: маленькие, так называемые нестабильные бляшки, могут разорваться, что приведет к образованию тромба на их поверхности. Тромбы закупорят артерии, и тогда... в лучшем случае — острое коронарное событие.
Все эти процессы могут ускоряться и утяжеляться факторами риска, которые действуют синергично: повышенным давлением, курением, ожирением, диабетом, малоподвижным образом жизни и, как становится очевидно в последнее время, — генетической предрасположенностью. Вдобавок повышенный уровень холестерина влияет не только на артерии, но и на сердечную мышцу, вызывая сердечную недостаточность.
Одно из самых главных доказательств, что именно избыточный холестерин главный виновник атеросклероза, — это многократно проверенный факт: если содержание холестерина повышено, его лекарственное понижение снижает смертность от сердечно-сосудистых заболеваний. Но было бы полезно разобраться в деталях: что и почему происходит на пути от липидного шарика в крови до бляшки в сосуде. Тогда мы, во-первых, сможем выявлять начало атеросклероза как можно раньше, задолго до изменений в кардиограмме. А во-вторых, создадим лекарственные препараты, которые будут не снижать холестерин, а предотвращать его повышение.
Когда много плохого и мало хорошего
Итак, липопротеины - это частицы сферической формы, оболочка которых состоит из фосфолипидов, а внутри содержатся холестерин (точнее, эфир холестерина) и триглицериды. Белки, которые расположены на поверхности липопротеинов, называют аполипопротеинами, или апопротеинами. Именно они определяют судьбу холестерина — высвободится ли он из «упаковки», чтобы его поглотили клетки, или, наоборот, излишний холестерин будет удален из тканей и крови, упакован внутрь липопротеиновой частицы и направлен в печень. Как правило, апопрстеины — это коферменты (активаторы) ферментов, обеспечивающих метаболизм холестерина и триглицеридов. Апопротеины могут отсоединяться от одних липопротеинов и присоединяться к другим, тем самым меняя их «специализацию». Если сравнить фосфолипидную оболочку с конвертом, то апопротеин — это адрес, прямой или обратный.
Есть два основных типа липопротеинов. Первый из них содержит «плохой» холестерин. Правильное его название— холестерин липопротеинов низкой плотности — Х-ЛПНП (прошу прощения за неблагозвучную аббревиатуру, но без нее никак). Частицы Х-ЛПНП содержат преимущественно эфир холестерина и малые количества триглицеридов, поэтому и плотность у них низкая. На поверхности каждой частицы расположена одна молекула аполипопротеина — АпоВ (рис. 2). Этот белок обеспечивает «распаковку» холестерина и передачу его в клетки.
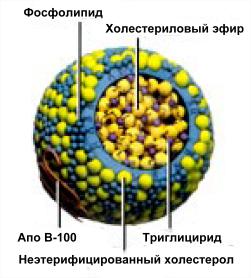
Рис. 2. Строение холестерина липопротеинов низкой плотности — Х-ЛПНП. Частицы холестерина липопротеинов высокой плотности Х-ЛПВП имеют похожую организацию, но их основной аполипопротеин — АпоА
Содержание частиц Х-ЛПНП в крови определяется тем, сколько их синтезируется в печени и сколько уходит обратно в печень. Клетки печени распознают в крови избыточный Х-ЛПНП с помощью особых поверхностных рецепторов и «заглатывают» его. (За открытие этих рецепторов американские генетики Майкл Браун и Джозеф Голдстайн в 1985 году получили Нобелевскую премию.)
Второй главный игрок в этой команде — холестерин липопротеинов высокой плотности, Х-ЛПВП. Он «хороший». Именно он обеспечивает обратный транспорт — направление избыточного холестерина из тканей в печень. Иногда Х-ЛПВП называют «мусорщиком» или «дворником» (scavenger) — ведь он очищает от холестерина поверхности клеток и другие липопротеины. Эти пустые «мусорные контейнеры» секретируются в печени и кишечнике. Печень же расщепляет Х-ЛПВП после его странствия по организму, причем собранный в нем холестерин или экскретируется в виде желчных солей, или используется вновь. У Х-ЛПВП есть и другие хорошие свойства — противовоспалительные и антиоксидантные. Но о них мы поговорим позже. Здесь скажем только, что основной белок Х-ЛПВП - аполипопротеин А-I, или АпоА.
(На самом деле липопротеинов, связанных с холестерином, гораздо больше. Например, «съеденный» холестерин из кишечника в печень переносят хиломикроны, громадные частицы диаметром до 500 нм. Для сравнения, диаметр Х-ЛПВП — до 15 нм.)
Итак, «плохой» Х-ЛПНП называют атерогенным - вызывающим атеросклероз, а Х-ЛПВП — антиатерогенным. Это показали многочисленные проспективные исследования. Например, у 10 000 исходно здоровых мужчин и женщин в течение 10 лет регулярно измеряли уровни Х-ЛПНП и Х-ЛПВП. За это время у некоторых добровольцев возникал атеросклероз, происходили нефатальные и фатальные инфаркты миокарда, ишемические инсульты (вызванные атеросклерозом сонной артерии, снабжающей кровью мозг). Так вот, было доказано, что повышение уровня «плохого» Х-ЛПНП и понижение уровня «хорошего» Х-ЛПВП повышают риск возникновения всех этих опасных недугов.
Выяснилось, однако, что дело не только в количестве, но и, как ни странно, в расфасовке.
Мелкий враг коварней крупного
Частицы Х-ЛПНП сильно различаются по своему липидному составу, заряду, размеру и даже по форме. И чем меньше диаметр частиц Х-ЛПНП, тем они опаснее. Такие частицы Х-ЛПНП были названы мелкими плотными (по сравнению с «нормальными» они имеют более высокую плотность и пониженное содержание триглицеридов).
Теперь самое время познакомиться с новым термином — «предиктор», от английского predict - предсказывать. Предиктором медики называют соединение, изменение концентрации которого предсказывает возникновение некой патологии или группы патологий. Например, мелкие частицы Х-ЛПНП — предиктор сердечно-сосудистых заболеваний и острых коронарных событий. Будучи более мелкими и плотными, они быстрее проникают в стенки сосудов и вызывают образование бляшек. К тому же они медленнее поглощаются печенью, поскольку у них изменено сродство к рецепторам печени и, как следствие, больше срок жизни в плазме (рис. 3). В общем, тот самый случай, когда «шесть чекушек гораздо хуже трех пол-литр»...
Уровень мелких плотных частиц Х-ЛПНП в значительной степени предопределяется генетическими факторами. А повышение этого уровня связано не только с повышенным риском сердечно-сосудистых заболеваний, но и с метаболическим синдромом (это глубокое очень опасное изменение в обмене веществ), и с неинсулинзависимым диабетом.
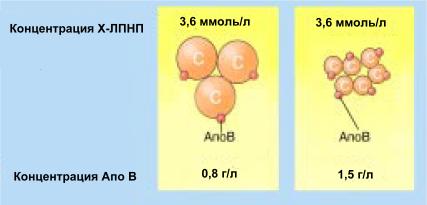
Рис. 3. При одинаковой концентрации Х-ЛПНП в одном случае количество мелких плотных частиц (определяемых по концентрации АпоВ) в два раза выше, чем в другом. В этом случае в два раза выше и риск сердечно-сосудистых заболеваний
Итак, у двух лиц с одинаковыми уровнями холестерина, связанного с Х-ЛПНП и с Х-ЛПВП, могут быть разные риски и разные тяжести атеросклероза, — если у одного из них большая часть «плохого» холестерина расфасована в мелкую упаковку. Но можно ли измерять размеры частиц Х-ЛПНП в биохимической лаборатории обычной центральной районной больницы? Теоретически — можно, на деле — увы. Для этого нужны электрофорез в полиакриамидном геле в неденатурирующих условиях, или электронная микроскопия, или высокоэффективная гель-фильтрационная хроматография, или (мечтать так мечтать) ядерная магнитно-резонансная спектроскопия... А нет ли метода попроще?
Вспомним, что на каждую частицу Х-ЛПНП, независимо от ее размера, приходится только одна молекула апопротеина В. Измерить концентрацию этого белка можно с помощью иммунологических методов (например, иммунотурбидиметрии). Одновременно измерим и концентрацию АпоА, его тоже только по одной молекуле на каждую частицу Х-ЛПВП.
В марте 2006 года на страницах одного из самых престижных медицинских журналов появился «манифест», подписанный тридцатью специалистами из 10 стран («Journal of Internal Medicine», 2006; 259 (3)). Они призывают установить новые правила для оценки риска сердечно-сосудистых заболеваний — заменить принятое сейчас определение в плазме общего холестерина, Х-ЛПНП и Х-ЛПВП на измерение концентраций АпоВ и АпоА. Ведь риск атеросклероза связан не столько с концентрациями холестерина, сколько с количеством атерогенных и антиатерогенных частиц, которые присоединяются к стенкам сосудов и проникают в артериальные стенки. Именно баланс АпоВ/АпоА — самый точный индикатор риска у лиц с бессимптомными сердечно-сосудистыми заболеваниями, а также у диабетиков. Более того, отношение АпоВ/АпоА — самый адекватный показатель эффективности терапии, направленной на снижение «плохого» холестерина.
Но уменьшение размера частиц Х-ЛПНП — к несчастью, далеко не единственное, что делает «плохой» холестерин очень плохим. Есть весьма убедительные указания на то, что избыток глюкозы в крови диабетиков приводит к нарушению обмена холестерина: главная причина смертности таких больных — сердечно-сосудистые заболевания, вызванные гиперхолестеринемией. Высокая глюкоза ведет к высокому холестерину. Но как?
Прежде всего, путем гликозилирования — неэнзиматического присоединения глюкозы к апопротеину В. Такой модифицированныйАпо В делает частицы Х-ЛПНП более атрогенными. Получается, что из двух пациентов с одинаковым количеством частиц Х-ЛПНП одинакового размера в худшем положении тот, у кого больше глюкозы в крови, — его «плохой» холестерин опаснее.
Похоже, традиционная концепция атерогенеза становится прокрустовым ложем для новых фактов: все, что в нее не укладывается, подлежит «обрубанию». В этом ложе удобно располагается нарушение баланса «хорошего» и «плохого» холестеринов, но что делать с другими фактами? Не замечать их? Не видеть, что изменения концентраций холестерина, связанного с липопротеинами, не объясняют всех случаев риска сердечно-сосудистых заболеваний? Закрыть глаза на то, что примерно половина всех сердечных приступов и ишемических инсультов происходит при нормальных холестеринах? А между тем размер «плохих» частиц и уровень гликозилированияапопротеина — лишь два факта из множества...
Слепая артиллерия неспецифического иммунитета
Как известно, у человека есть неспецифический и специфический иммунитет. С неспецифическим мы рождаемся, специфический приобретаем при столкновении с инфекциями. Его основа — антитела, синтезированные лимфоцитами при их контакте с антигенами. Обычно для синтеза нужных антител и, следовательно, для уничтожения инфекционного агента требуется как минимум несколько дней. И весьма вероятно, что появление в крови этого
высокоточного оружия, мягко говоря, слегка запоздает. В 1346—1351 годы в Западной Европе бушевала «черная смерть» — бубонная чума, от которой умерло более 25 миллионов человек. Из десяти заболевших выживал только один...
К счастью, в борьбе со смертоносными врагами нас может выручить «оружие массового поражения» — неспецифический иммунитет. Он состоит из комплекса защитных факторов, заранее готовых к бою, независимо от того, проник ли враг в организм. Неспецифический иммунитет обеспечивает однотипные и простые реакции на любые чужеродные антигены. Его главные клеточные компоненты — фагоциты, а неклеточные — система комплемента, цитокины, интерлейкины, С-реактивный белок (этот последний персонаж будет для нас особенно важен). Основная задача фагоцитов — захватывать и переваривать микроорганизмы. Система комплемента — это группа белков, которые, взаимодействуя в строго определенной последовательности, разрушают и стенки бактериальных клеток, и — внимание! — стенки собственных клеток организма. Образно говоря, неспецифический иммунитет — это тяжелая артиллерия, которая, уничтожая смертельного врага, бьет и по своим. И делает это сразу. Как иногда пишут в обзорных статьях, fastbutblunt — быстрая, но слепая.
Основа неспецифического иммунитета — «химическое оружие»: окисление бактериальных клеток за счет специально синтезируемых активных форм кислорода. Молекулярный кислород сам по себе внутри организма в неконтролируемые реакции обычно не вступает. Чтобы перевести кислород в боевую форму, нужны ферменты: оксидазы и оксигеназы.
Главные активные формы кислорода — супероксидные радикалы (О2), перекись водорода (Н2О2), гидроксильные (свободные) радикалы (*ОН, НО2*), синглетные формы кислорода (1О2), ионы НО2-. Когда фагоцитирующая клетка вступает в контакт с врагом, в ее плазматической мембране активируется НАДФ*Н-оксидаза, которая из свободного молекулярного кислорода образует О2- . В конечном счете с участием ионов железа происходит дисмутация активной формы кислорода до Н2О2. Выброс активных форм кислорода убивает бактериальные клетки.
Центральный нападающий в этой атаке — миелопероксидаза, гем-содержащий фермент фагоцитов. Когда эти клетки активируются чужеродным агентом, часть молекул миелопероксидазы выбрасывается во внеклеточное пространство. Снаружи клетки много хлорида, который этот фермент превращает в хлорноватистую кислоту: H2O2 + Cl - + H3O - = HCIO + 2 H2O. Ее соли, гипохлориты, — сильнейшие окислители и, следовательно, мощные антимикробные средства. Кроме того, миелопероксидаза катализирует реакцию между NO и Н2О2, которая дает пероксинитрит OONO - еще один мощный окислитель. Такое химическое оружие может повреждать ткани собственного организма. Это и происходит при многих воспалительных процессах, таких, как ревматоидный артрит, кистозный фиброз, воспалительные заболевания кишечника, сепсис, заболевания легких у новорожденных.
Так почему же природа изобрела и повсеместно внедрила этот обоюдоострый механизм неспецифического иммунитета? Потому, что был выбор: или верная и быстрая смерть от инфекций, или вероятная и медленная — от атеросклероза.
Но при чем здесь атеросклероз?
Осмотр на месте преступления
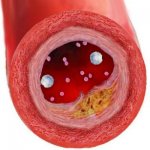
При том, что миелопероксизада, по образному выражению исследователей, «дымящийся пистолет», всегда обнаруживаемый на «месте преступления» — в атеросклеротических повреждениях стенок сосудов. Отсюда и тяжкое обвинение: одна из главных причин атеросклероза — не повышение уровня Х-ЛПНП, а его окисление за счет миелопероксидазы. Этот фермент, как уже говорилось, образует целый букет высокореактивных соединений. А они окисляют и модифицируют в «плохом» Х-ЛПНП практически все — белки, фосфолипиды, холестерин. Нормальный, пусть «плохой», но «свой» Х-ЛПНП превращается в окисленный и уже «чужой» Х-ЛПНП. И тогда иммунная система начинает его уничтожать. Макрофаги опознают модифицированный АпоВ как чужеродный агент и начинают интенсивно поглощать окисленный Х-ЛПНП. При этом они становятся так называемыми пенистыми клетками, перегруженными окисленными фосфолипидами и холестерином. И в стенках артерий начинается медленный воспалительный процесс (рис. 4).
Второй «дымящийся пистолет», как многократно и четко показано, — это собственно повышенные уровни окисленного Х-ЛПНП. Они значительно повышают риск атеросклероза, острых коронарных событий и ишемических инсультов.
Часто появляются сообщения, что атеросклероз — инфекционное заболевание. И в самом деле, если атеросклероз — это воспалительный процесс, вызванный активацией неспецифического иммунитета, то микробы, основная мишень иммунитета, могут заодно с воспалением вызывать и атеросклероз. В одном из недавних исследований изучалась связь между окисленным Х-ЛПНП, хроническими инфекциями (кишечная палочка Escherichia coli, хламидии Chlamydia pneumonia, возбудитель язвы Helicobacter pylori, цитомегаловирус) и атеросклерозом сонной артерии. Подозрения подтвердились. У пациентов с клиническими проявлениями хронических инфекций наблюдались и высокие уровни окисленного Х-ЛПНП, и высокие показатели тяжести атеросклероза. Так что связь действительно есть. Инфекции активируют неспецифический иммунитет, а он повреждает ключевые компоненты метаболизма холестерина, вызывает воспаление в сосудистой системе и, следовательно, сердечно-сосудистые заболевания.
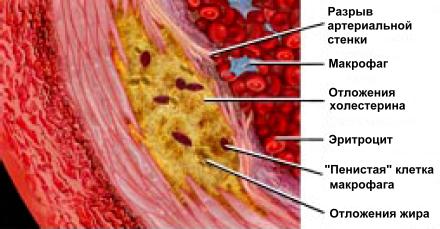
Рис. 4. Строение атеросклеротической бляшки, образовавшейся в результате воспалительного процесса
Таким образом, атеросклероз — не инфекционное заболевание, но хронические инфекции могут приводить к его возникновению и развитию.
Еще один соучастник — фосфолипаза А2, ассоциированная с липопротеинами. Ее цель благородна: уничтожать подвергнувшиеся окислению фосфолипиды, которые содержатся уже в совсем «плохом» окисленном Х-ЛПНП. Но с другой стороны, высокий уровень этой фосфолипазы — тревожный признак, ведь она присутствует в атеросклеротических бляшках. А ее повышенная активность — предиктор заболеваний коронарных артерий, инфарктов миокарда и ишемических инсультов. (Что касается инсультов, этот предиктор более надежен, чем уровень холестерина!Тест для определения уровня этого фермента в плазме одобрен в США для оценки индивидуального риска ишемического инсульта.)
Итак, в атеросклеротических повреждениях обнаруживаются миелопероксидаза, окисленный ею Х-ЛПНП и фосфолипаза А2, которая это безобразие пытается удалить. Но там же обнаруживается еще один «дымящийся пистолет», и какой! Настоящий крупнокалиберный «магнум». Это СРБ — С-реактивный белок (читается как «Ц-реактивный»).
Тот, кто отдал приказ
У человека, как и у других млекопитающих, в воспалительном процессе есть «острая фаза» — важнейшее звено неспецифического иммунитета. Для острой фазы характерны повышенная температуры, изменение проницаемости сосудов, а также биосинтетического и метаболического профиля многих органов. В развитии этого процесса участвуют системы всего организма: иммунная, центральная нервная, эндокринная, сердечно-сосудистая.
Белки острой фазы — это около 30 белков плазмы крови, которые синтезируются в печени. Важнейшее свойство большинства этих белков — их неспецифичность по отношению к первопричине воспаления («семь бед — один ответ»), высокая корреляция их концентраций в крови с тяжестью заболевания. А роль их состоит в том, чтобы ограничить очаг повреждения, удалить повреждающий фактор, восстановить нарушенную структуру.
СРБ - это центральный нападающий острой фазы воспаления. Как только в организме появляется чужеродный агент — бактерии, вирусы, частицы некротизированной ткани, — это запускает синтез СРБ. И его уровень в крови возрастает не только очень быстро, в первые 6—8 часов, но и очень резко — в 20—100, а иногда и в 1000 раз! (Нормальная концентрация СРБ в плазме здорового человека составляет 1,0 мг/л.)
Этот белок состоит из пяти одинаковых субъединиц, нековалентно связанных между собой. На одной стороне молекулы расположен участок, с которым, в присутствии ионов кальция, связываются «чужие» лиганды, на другой участок, который, после того как первый распознал врага, включает систему уничтожения — так называемый каскад комплемента.
Так вот, при концентрациях СРБ меньших, чем 1,0 мг/л, риск сосудистых осложнений (таких, как острый инфаркт миокарда, инсульт) минимальный. При 1,1—1,9 — низкий. При 2,0 — 2,9 — умеренный. При больших, чем 3 мг/л, — высокий. Есть над чем задуматься.
Доказано, что СРБ специфически связывается с окисленным Х-ЛПНП — а коль скоро связывается, то и включает воспалительный процесс в стенках артерий. Кроме того, его находят в местах преступлений: на воспаленной поверхности атеросклеротических сосудов, в бляшках, в поврежденных участках при остром инфаркте. А самое важное — увеличение его концентрации связано с повышенным риском коронарных приступов, даже если концентрация холестерина в норме.
И пожалуй, одно из самых серьезных доказательств виновности СРБ в атерогенезе — недавно синтезированный ингибитор этого белка. Он был создан на основе комплекса СРБ и фосфохолина — компонента бактериальных мембран, к которому СРБ имеет наибольшее сродство. В опытах на мышах этот ингибитор уменьшал риск смертности и предотвращал увеличение зоны инфаркта.
В общем, вердикт мировой медицинской общественности по поводу роли СРБ в развитии атеросклероза и его тяжких осложнений единодушен: «Виновен!» Похоже, что приговор окончательный и обжалованию не подлежит.
Когда «хороший» становится «плохим»
Разумеется, все, что здесь говорится о холестерине, неспецифическом иммунитете и атеросклерозе, — сильное упрощение. Если сравнить реальную общую картину метаболизма холестерина, например, с многоходовыми схемами уклонения от налогов, последние будут выглядеть проще пареной репы.
Казалось бы, частицы Х-ЛПВП — однозначно хорошие: удаляют избыточный холестерин из тканей и крови, обладают антиатерогенными, антиоксидантными, противовоспалительными и другими полезными свойствами. С ними связан особый фермент параоксоназа 1, который предотвращает окисление Х-ЛПНП и даже расщепляет токсичные окисленные липиды в составе о-Х-ЛПНП. Можно ли было ожидать, что при воспалении Х-ЛПВП из анти-атерогенного станет атерогенным?
Оказывается, при острой фазе воспаления снижается концентрация основногоапопротеина Х-ЛПВП — АпоАкоторый обеспечивает обратный транспорт холестерина. И более того, также снижается уровень параоксоназы 1. Таким образом, при воспалительном процессе большинство из антиатерогенных функций Х-ЛПВП превращаются в свою противоположность. И «хороший» Х-ЛПВП становится «плохим».
Но зачем это делается? Вопрос «зачем?» вполне правомерен: ведь если окисление Х-ЛПНП при воспалении — побочный эффект действия неспецифического иммунитета, то переход в острой фазе воспаления антивоспалительного Х-ЛПВП в провоспалительную форму больше похож на запрограммированный механизм. Неужели для того, чтобы человек, не погибший от острой инфекции, медленно умирал от атеросклероза?
Есть точка зрения, что Х-ЛПВП появился в процессе эволюции как составная часть системы неспецифического иммунитета. И его антивоспалительные свойства — дополнительная функция, направленная на предотвращение воспаления в отсутствие острой фазы. А при остром воспалении перевоплощение Х-ЛПВП из доктора Джекила в мистера Хайда усиливает воспалительный процесс, цель которого — восстановление нормы. А уж если при этом начинается атеросклероз, то... извините, организму не до того. Лечим сначала самое страшное и неотложное, выживем — там разберемся.
Разобрались. У лиц с сердечно-сосудистыми заболеваниями действительно часто обнаруживается «плохой» — провоспалительный и атерогенный вариант Х-ЛПВП.
Но это, к несчастью, еще не все, что делает воспаление с Х-ЛПВП. Не будем забывать о миелопероксидазе. Как оказалось, она окисляет и его тоже. АпоА частиц Х-ЛПВП, циркулирующих в плазме пациентов с сердечнососудистыми заболеваниями, содержит много 3-нитро-тирозина и 3-хлортирозина — это признаки активности миелопероксидазы. Хлорирование и нитрированиеАпоА приводит к уменьшению обратного транспорта холестерина, осуществляемого Х-ЛПВП.
Итак, Х-ЛПВП — действительно «хороший». Но до поры до времени. Как только в организме начинается воспалительный процесс — и он становится «плохим».
Еще одна загадка — липопротеин (а)
Обозначается он как Lp (a), а читается как «липопротеин «а» малое». Это опасный родственник «плохого» Х-ЛПНП. Собственно, он и есть Х-ЛПНП, но с довеском: еще одним белком — апопротеином (а), который связан с АпоВдисульфидной связью. Опасность его предопределяется генетически — размером гена апо (а). У кого ген Апо (а) короткий, у того и жизнь может быть такой же. Ибо чем меньше размер апопротеина (а), тем выше концентрация частиц Lp (a) в крови. А атерогенность у них очень высокая. Из-за того что уровни Lp (a) заданы генетически, понизить его концентрацию в крови практически невозможно ни изменением диеты, ни снижением веса, ни препаратами, обычно применяемыми для снижения холестерина (статины). Тем не менее измерять уровни Lp (a) рекомендуется лицам с ранними проявлениями сердечно-сосудистых заболеваний, тем, у кого от этих заболеваний страдают близкие родственники, и тем, у кого терапия, направленная на снижение холестеринов, их не снижает. Итак, согласно современным представлениям атеросклероз — это вызываемый неспецифическим иммунитетом вялотекущий воспалительный процесс в стенках сосудов. Однако в последнее время было сделано тревожное открытие. Стало ясно, что неспецифический иммунитет активируется различными и крайне неожиданными факторами, не имеющими отношения ни к инфекциям, ни к чужеродным агентам. Такими факторами могут быть, во-первых, внутренние нарушения метаболизма, во-вторых, гомеостатические стрессы (стрессы, которые нарушают координирование физиологических процессов, поддерживающих устойчивые состояния организма), в-третьих, преддиабетические состояния, в-четвертых, ранние нарушения тканей (почечных, легочных, соединительных) и, наконец, в-пятых — внешние факторы, не связанные с внедрением в организм чужеродных агентов. Новая модель активации неспецифического иммунитета названа «моделью опасности». О каких опасностях она предупреждает и как им противостоять — можно увидеть на схеме.
Но что это все означает? Побочный эффект мощной артиллерии неспецифического иммунитета, которая, поражая смертельного врага, бьет и по своим? Или может быть, в каких-то особых условиях организм почему-то сам подает команду «Огонь на меня!»?
Мы под Колпином скопом лежим
И дрожим, прокопченные дымом.
Надо все-таки бить по чужим,
А она — по своим, По родимым.
По материалам журнала «Химия и жизнь XXI век» № 12 за 2006 год
Закладки по теме: атеросклероз, холестерин, холестерол
Комментариев: 0










 Чтобы сообщить нам о грамматической ошибке на сайте
выделите её и нажмите Ctrl+Enter
Чтобы сообщить нам о грамматической ошибке на сайте
выделите её и нажмите Ctrl+Enter